医薬品リスク管理計画
令和2年度調剤報酬改定において、『薬剤服用歴管理指導料』の服薬指導等に用いる資材に、「(1)必要に応じて、医薬品リスク管理計画( RMP)に基づく患者向け資材を活用することとした」が追記されました。医薬現場において、まだ十分に利活用できていない『医薬品リスク管理計画』について概説します。
■医薬品リスク管理計画■
『医薬品リスク管理計画』(RMP : Risk Management Plan)とは、個々の医薬品のリスク(副作用)について、承認・審査の段階から安全性上の検討課題を特定し、市販後に実施される「情報収集」や医薬従事者への「情報提供」など、医薬品のリスクを低減するための一連の取り組みを文章化したものです。
厚生労働省やPMDAの指導のもと、製薬企業が作成します。製造市販後の安全対策を充実強化することを目的として、2013年4月以降に申請された医薬品から作成されています。
→ 従来は、重大な副作用が起きたら「緊急安全性情報」などで周知する「警報発信・事後対応型」でした。薬害肝炎を未然に防げなかった反省から「予測・予防型」の安全対策にシフトしました。製薬企業の立場で考案された行動計画書なので、現場の薬剤師には多少読みづらい文面もあります。
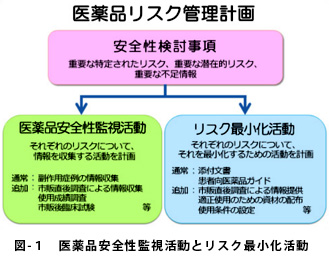
1、RMPの概要
RMPは、❶安全性検討事項(重要な特定されたリスク・潜在的リスク・不足情報)、❷医薬品安全性監視活動(通常。追加)、❸リスク最小化活動(通常・追加)の3要素から構成されています。(図1)
■ 1)安全性検討事項
治験時の症例は限られているため、全ての副作用を把握することはできません。
安全性検討事項は、
①重要な特定されたリスク、②重要な潜在的リスク、③重要な不足情報に区分されます。
特定された副作用は、添付文書に記載されます。
添付文書に記載できない潜在的リスクや情報不足の患者群は、
設定理由(リスクの根拠)もRMPに記載されます。(図2)
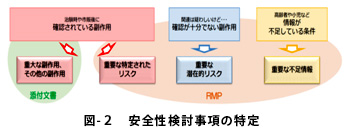
→ 十分確認されていない、疑われる副作用にまで踏み込みました。
(1)重要な特定されたリスク
開発段階で、すでに医薬品との関連性が確かめられた副作用です。
添付文書に「重大な副作用」「その他の副作用」に分けて記載されます。
市販後は「添付文書の改訂」で随時、副作用が追加されます。
→ 薬剤師が提供しなければならない薬学的に重要な知見です。
(2)重要な潜在的リスク
関連性が疑われるが、開発段階で十分確認されていない副作用です。
例えば、薬理作用から予測されるが、臨床的に確認されていない副作用、
同種同効薬で認められる副作用などが該当します。
→ リスクと判断した根拠が、臨床と基礎データで解説されています。
(3)重要な不足情報
治験対象から除外されている「高齢者、腎機能障害患者、肝機能障害患者、
妊婦、授乳婦、小児」などに関する情報で、市販後に情報が収集・蓄積されます。
→ 既知の副作用だけでなく、常に最新の副作用情報に更新します。
■ 2)医薬品安全性監視活動
「安全性検討事項」を踏まえて、市販後にどのような「情報収集」をするかが
記載されています。特定の病態や高齢者の使用、長期投与時の安全性など、
追加の安全性監視活動が明示されます。副作用症例の情報などを収集する
「通常の活動」と、市販直後調査や特定使用成績調査などの
「追加の活動」があります。
→ PMDAの副作用報告制度を活用し、積極的に報告しましょう。
■ 3)リスク最小化活動
重要な特定されたリスクに関して、どのように「情報提供」をするかが記載されます。
どのような患者に注意が必要なのかは、「使用上の注意」に記載されます。
「添付文書」や「患者向け医薬品ガイド」などの「通常の活動」と
「医療従事者向け資材(適正使用ガイド等)や「患者向け資材(患者ガイド等)」の
「追加の活動」があります。
→ 「患者向け資材」「適正使用ガイド」を服薬指導に活用しましょう。


RMPのアクセス方法
医薬品リスク計画の閲覧には、いくつかの方法があります。
PMDAの医薬品情報提供ホームページ(https://www.pmda.go.jp/)の
添付文書検索から個別の医薬品を検索し、一般名をクリックするのが一般的です(図3)。
このページからRMPおよび「患者向け資材」を選択します。
RMPは、原則A41枚にまとめられています。PMDAメディナビに登録しておくと、
新規に掲載されたRMPのお知らせメールが届きます。


患者向け資材の利活用とRMPマーク
RMPの「追加のリスク最小化活動(情報提供)」の一環として作成される
「医療従事者向け資材」 「患者向け資材」(図4)は、
認識しやすいようにRMPマークが表示されています。
RMPを読めば、「患者向け資材」の目的と作成理由が確認できます。
目的を理解して服薬指導やフォローアップに積極的に利活用しましょう。
「患者向け資材」は、MRや製薬企業のHPなどから入手できます。

具体的な利活用
薬の専門家である薬剤師は、調剤時だけでなく、医薬品の服用期間を通じて、
服薬状況を把握し、薬学的知見に基づく指導を行うことが義務付けられています。
また、情報の収集や提供だけでなく、自らが副作用モニタリングを行い、
医師や病院薬剤師と連携することが重要です。
薬薬連携、在宅医療の充実、地域全体でのシームレスな情報共有が望まれています。
・初回購入時、新薬のヒアリング時、製品説明会で
・「重要な特定されたリスク」を、患者モニタリングに
・追加の「安全性監視活動」で指定された集団を重点的にフォローする
・副作用の原因薬剤調査に、「潜在リスク」の情報を活用
・保険薬局と病院薬剤師、医師との連携のツールとして
ただし、複数の効能を有する医薬品では、適応疾患ごとに患者の病態が異なるので
注意が必要です。
引用文献
1)医薬品医療機器安全性情報No.300、平成25年3月25日
2)病院薬剤師業務への医薬品リスク管理計画の利活用について、
日本病院薬剤師会、医薬情報委員会、平成26年12月15日
3)薬局薬剤師業務での医薬品リスク管理計画(RMP)の活用について、
日本薬剤師会、DI・医療安全・DEM委員会、令和元年11月
4)若林進監修、3分でわかる!RMP講座第2版、
PMDA安全性情報・企画管理部リスクコミュニケーション推進部

